Determinación del contenido de compuestos polifenólicos en hojas de Acacia polyphylla en diferentes estados fenológicos
Determination of the content of polyphenolic compounds in Acacia polyphylla leaves in different phenological stages
Patricia Alarcón a; Lisbeth Giménez a; Gustavo Nouel-Borges b, *; Gilda Castillo a
a Unexpo, Barquisimeto, Lara, Venezuela.
b Decanato de Agronomía, UCLA, Cabudare, Lara, Venezuela.
: G. Nouel-Borges [ genouelb@yahoo.es | https://orcid.org/0000-0002-3746-4234 ]
G. Castillo [ apubp@unexpo.edu.ve | https://orcid.org/0009-0009-1576-1068 ]
Resumen
Este trabajo de investigación permitió conocer la cantidad y naturaleza de compuestos polifenólicos, presentes en cada uno de los estados fenológicos de la Acacia polyphylla, mediante la extracción y caracterización en muestras de hojas frescas y deshidratadas (55 °C). La extracción se realizó con una solución acidificada de éter de petróleo y una solución acuosa de etanol; para la caracterización y cuantificación se aplicaron las técnicas descritas para el Análisis de Taninos (Makkar; 2000). En las hojas de Acacia polyphylla, los valores más altos de taninos totales (5,297%), polifenoles totales (5,386 %), fenoles simples (0,0896%) y taninos que precipitan las proteínas (0,319%) se obtuvieron en el crecimiento activo de la planta, y taninos condensables fue similar en todos los estados; mientras que los niveles más bajos fueron medidos en fructificación para fenoles simples (0,045%) polifenoles totales (2,348%), taninos totales (2,303%) y taninos que precipitan proteínas (0,128%). El tratamiento térmico realizado al deshidratar a 55 °C redujo la cantidad de compuestos fenoles simples y taninos que precipitan proteínas.
Palabras clave: compuestos polifenólicos; taninos; Acacia polyphylla; estados fenológicos.
Abstract
This research work allowed us to know the quantity and nature of polyphenolic compounds, present in each one of the phenological stages of Acacia polyphylla, through the extraction and characterization in fresh and dehydrated (55 °C) leaf samples. The extraction was carried out with an acidified solution of petroleum ether and an aqueous solution of ethanol; For the characterization and quantification, the techniques described for Tannin Analysis (Makkar; 2000) were applied. In Acacia polyphylla leaves, the highest values of total tannins (5.297%), total polyphenols (5.386%), simple phenols (0.0896%) and protein-precipitating tannins (0.319%) were obtained in active growth of the plant, and condensable tannins were similar in all states; while the lowest levels were measured in fruiting for simple phenols (0.045%) total polyphenols (2.348%), total tannins (2.303%) and protein precipitating tannins (0.128%). The thermal treatment carried out when dehydrating at 55 °C reduced the amount of simple phenolic compounds and tannins that precipitate proteins.
Keywords: polyphenolic compounds; tannins; Acacia polyphylla; phenological stages.
- Introducción
Las leguminosas son plantas que fijan nitrógeno gaseoso del aire y lo transforman en proteína vegetal de utilidad en nutrición animal y humana (Pirie, 2008; Yáñez-Ruiz & Belanche, 2020). En tiempos de cambio climático y desertificación de grandes superficies de terrenos con fines agrícola; las leguminosas arbóreas y arbustivas capaces de crecer en ambientes secos y sin riego, pueden ser una alternativa para la nutrición animal y para la protección de terrenos desnudos (Nouel-Borges, 2015). La Acacia polyphylla (Willd), Familia: Mimosacea, Orden: Fabales, Subclase: Rosidae, Clase: Magnoliopsida (Dicotiledónea), Género: Acacia, Especie: polyphylla DC, Sinónimos: Acacia riparia, Bertero, Acacia glomerosa, Benth, Senagalia glomerosa, Britton y Rose, Senegalia langlassei, Britton y Rose, Acacia langlassei, Bullock (Rico, 2001), nombres vulgares: Cujuba, Monjoleiro, Pashaco Negro, Paricarana, Tiamo, Carbonero. La Acacia polyphylla es una especie arbórea que crece en ambientes semiáridos sin riego alguno, con disponibilidad de nutrientes (proteína y energía) que pueden ser de utilidad para herbívoros lagomorfos y rumiantes (Nouel-Borges, 2015; Yáñez-Ruiz & Belanche, 2020). Las leguminosas, como otras plantas, producen una importante y diversa cantidad de compuestos secundarios (fenoles, polifenoles, taninos simples, condensables y que precipitan proteínas, entre otros tantos) como respuesta al suelo, clima, plantas vecinas, interacción con microorganismos e insectos y respuesta al consumo de sus partes por los herbívoros, con acción antioxidante, antimicrobiana, insecticida, atracción a polinizadores, muta génicos, citotóxicos, anti-fúngicos, y anti herbívoros, entes tantas otras como lo refieren Brooks & Owen-Smith (1994), Makkar (2003), Wink (2013) y Yáñez-Ruiz & Belanche (2020). La presencia de compuestos secundarios, como respuesta de protección a la acción de los herbívoros que las consumen, limitan la disponibilidad de nutrientes y aumentan el rechazo o consumo en los animales que las incluyen en su dieta (Torregrossa & Dearing, 2009; Espejo-Díaz & Nouel-Borges, 2014; 2020; Yáñez-Ruiz & Belanche, 2020). Estas sustancias varían con la etapa fenológica de cada vegetal, de modo que una posible acción para aprovechar estas especies es saber en qué momento los compuestos secundarios son menos concentrados en el follaje (Araujo Filho et al., 2002, Parissi et al., 2014). Por lo antes expuesto se planteó extraer, caracterizar y cuantificar los compuestos polifenólicos (taninos), presentes en muestras frescas o deshidratadas, en cuatro estados fenológicos de Acacia polyphylla, nativa del ambiente semiárido del Estado Lara Venezuela; como base de futuros estudios bioquímicos y fisiológicos en la nutrición y reproduc-ción de rumiantes y su explotación agronómica.
- Metodología
La recolección de muestras foliares la Acacia polyphylla se realizó en el Parque Botánico Dr. Héctor Ochoa Zuleta y los análisis de laboratorio en la Unidad de Investigación en Producción Animal Departamento de Producción Animal, Decanato de Agronomía, Univer-sidad Centroccidental “Lisandro Alvarado” (UCLA), Municipio Palavecino, Edo. Lara. Ubicados a una altitud de 510 metros sobre el nivel del mar y las condiciones climáticas predominantes son: temperatura promedio anual 25 °C, precipitación promedio anual 812,6 mm, humedad relativa de 74,6%, una irradiación solar de 371 cal cm-2 y evaporación promedio anual de 2.084,9 mm (Ortiz et al., 2015).
Recolección de las muestras. Para la toma de muestras se escogieron diez (10) plantas adultas, al azar dentro del Parque Botánico Dr. Héctor Ochoa Zuleta, se identificaron, para conocer cada individuo a muestrear para los distintos estados fenológicos. Antes de recoger el material a analizar, se definió la etapa de madurez de la planta, ya que la etapa del desarrollo afecta los niveles y la naturaleza de los fenoles. El material se transportó en estado fresco, dada la cercanía de la zona de recolección al laboratorio donde se procesaron las muestras (ambos sitios en el Decanato de Agronomía), evitándose una serie de procesos de conservación y transporte. Se seleccio-naron diez plantas de la especie para el análisis de cada estado fenológico: crecimiento activo (1), prefloración (2), floración (3) y fructificación (4). Para la recolección de las muestras se tomaron sólo las hojas de la especie en su respectivo estado fenológico, guardando las hojas en bolsas de polietileno de cierre hermético, debidamente rotuladas para su análisis. El proceso de recolección estuvo influenciado por las condiciones climatológicas, prolongándose por un año aproxima-damente.
Deshidratación de las muestras. La deshidratación se realizó a la mitad de las muestras; se secaron por 48 horas en un horno de aire forzado a una temperatura no mayor de 55 °C, puesto que puede conducir a la inactivación de fenoles o podría disminuir su extracta-bilidad en solventes y afectar la cuantificación, si se seca a temperaturas mayores. Una vez identificadas la especie y sus diferentes estados fenológicos (creci-miento activo, prefloración, floración y fructificación), se procedió a recolectar las muestras para efectuar los análisis de fenoles simples, fenoles totales, taninos totales, taninos condensables y taninos que precipitan las proteínas, utilizando las técnicas descritas por el manual para análisis de taninos de la Asociación Inter-nacional de Energía Atómica (Joint FAO/IAEA, 2000).
Extracción de taninos. El método para la extracción de taninos fue modificado del reseñado en el manual para el análisis de tanino de la Joint FAO/IAEA (2000). Cambiando los solventes para la extracción y la masa de las muestras. La extracción se realizó con dos soluciones diferentes, cambiando el solvente reco-mendado en el manual que era una solución de acetona al 70%, esto con la finalidad de obtener dos capas bien diferenciadas y lograr la separación de los taninos condensables de los hidrolizables (Martínez et al., 2000); de igual manera se acidificó el medio para extraer una mayor cantidad de taninos condensables (Chavan et al., 2001).
Fenoles totales. Se usó el método de Folin-Ciocalteu (Makkar et al. 1993) que permite conocer la eficacia de la extracción de fenoles en solventes. Los resultados se pueden expresar como equivalente de ácido tánico (mg acido tánico / % de materia seca). Se tomó la alícuota conveniente de cada fase (fase etérea y fase alcohólica) para cada extracto de manera que se ajustara al rango de la curva de calibración antes mencionada, Se colocó en una estufa a 40 °C hasta sequedad, restituyendo el volumen anterior con acetona al 70% y completando el volumen con agua des ionizada hasta 1 mL; se agregó 0,50 mL del reactivo de Folin-Ciocalteu (1N) y 2,5 mL de la solución de carbonato de sodio. Se agitaron los tubos de ensayo y después de 40 minutos se midió la absorbancia de cada solución a 725 nm. La cantidad de fenoles totales se calculó por equivalente de ácido tánico de la curva de calibración. Se expresó el contenido de fenoles totales sobre una base de la materia seca (%).
Remoción de taninos del extracto que lo contiene. Se realizó utilizando el polipirrolidona polivínilica (PVPP), el cual forma enlaces con los taninos, precipitándolos. Se pesaron 100 mg de PVPP en un tubo de ensayo. Se agregó el volumen de extracto y de agua des ionizada que se utilizó en el apartado anterior para cada caso. Se mantuvo el tubo a 4 °C durante 15 minutos, agitándolo, luego se centrifugó (3.000 rpm) por 10 minutos y se recogió el sobrenadante. Este sobrena-dante contiene fenoles simples que no son taninos, ya que los taninos precipitaron junto con el PVPP. Luego de transcurridos 40 min. se midió el contenido fenólico del sobrenadante a una absorbancia de 725 nm. El contenido de los fenoles simples se expresó sobre una base de materia seca.
Taninos condensables (Flavonoides: proantociani-dinas), según el método de Porter et al. (1986).
Taninos que precipitan las proteínas. Según Makkar et al. (1988). Análisis de los Pools en la formación del complejo tanino-proteína. Se tomaron diferentes alícuotas de cada pool (0,1; 0,15; 0,2; 0,25; 0,3; 0,35; 0,4 y 0,5 mL) y se completó el volumen a 1 mL con metanol al 50%, se le añadió 2 mL de la solución de BSA, se agitaron y la solución se dejó en reposo a 4 °C durante toda la noche. Se centrifugó (3.000 rpm) por 10 minutos y se retiró el sobrenadante sin agitar el precipitado. Se agregó 1,5 mL de la solución de SDS 1% al precipitado y se agitó para disolverlo.
Taninos que precipitan las proteínas como porcentaje de fenoles totales. Se tomaron alícuotas convenientes de cada extracto completando el volumen hasta 1 mL con SDS al 1% y se le añadió 3 mL de la solución SDS-trietanolamina y 1 mL del reactivo cloruro de hierro (III). Luego de 20 min. se midió la absorbancia a 510 nm. Se convirtió la absorbancia al equivalente de ácido tánico usando una curva de calibración para obtener los fenoles totales en el extracto. Se utilizaron las figuras obtenidas en el apartado anterior para convertir las absorbancias obtenidas en equivalentes de ácido tánico en el complejo tanino-proteína de cada uno de los extractos
Análisis estadístico. Luego de obtener los resultados, estos fueron analizados estadísticamente utilizando el programa STATISTIX versión 8.0 para Windows, en donde las medias de los valores finales para cada uno de los análisis se les aplicó la prueba de Tukey para separar medias (p ≤ 0,05) las medias con los errores estándar fueron graficadas usando el programa PASW Statistics 18 (SPSS, 2009).
- Resultados y discusión
En la Tabla 1 se tienen los valores de materia seca según cada estado fenológico. Se distingue que el menor contenido de materia seca fue en las hojas en crecimiento activo y el mayor en estado de fructi-ficación, donde la madurez es mayor, comportamiento normal para los ciclos de un vegetal.
En la Tabla 2 se muestran, para cada estado fenológico y tratamiento de la muestra, el análisis de la varianza para los resultados obtenidos en fenoles simples, polifenoles totales, taninos totales y taninos precipi-tables expresados como porcentaje equivalente en ácido tánico; así como también los porcentajes obtenidos de taninos condensables equivalentes a Leucocianidina (Leucoantocianidina C15H14O7 (2R,3S,4S)-2-(3,4-dihidroxifenil)-3,4-dihidro-2H-cromeneo3,4,5,7-tetrol); todos sobre la base de materia seca (55 °C). Se analizaron las medias en un diseño factorial, con el factor estado fenológico a cuatro niveles y el factor humedad del follaje a dos niveles (fresco o deshidratado a 55 °C), resultando que cada factor actuó independientemente, con ningún efecto de interacción entre ambos, lo cual permite analizar independientemente a cada factor. En lo que respecta a las determinaciones en fresco y seco a 55°C, se tiene que, para la mayoría de los análisis, excepto para taninos condensables, el contenido fue mayor en el follaje fresco que en el deshidratado a 55 °C.
Para fenoles simples, polifenoles totales, taninos totales, condensables y taninos que precipitan proteínas el estado de crecimiento activo es el que presenta la mayor concentración (Tabla 2). Por otra parte, fructificación es el estado donde se presentó el menor contenido para todos los fenoles y taninos evaluados. Para el caso de floración, hubo tendencia a aumentar para polifenoles totales, taninos condensables y taninos totales después de la prefloración, y luego bajando para como el resto hacia fructificación. Como lo refiere Wink (2013), las leguminosas en proceso de floración producen compuestos secundarios para proteger la estructura reproductiva y para atraer insectos polinizadores sea por coloración o aromas, compuestos que se presentan dentro de los grupos citados y deter-minados; más específicamente, Ung & Asmara (2023) reportan al menos 16 fitoquímicos en las partes florales de la Acacia saligna, con actividad antioxi-dante, anti-herbívoros y antimicrobianos. La madurez indicó mayor nivel de compuestos secundarios, lo cual se corresponde con lo referido por Makkar (2003) y Parissi et al. (2014).
Así, con respecto a los polifenoles totales, los valores encontrados son similares a los reportados por Cesarino et al. (2020), que, dependiendo del método de extracción, reportó de 2,60±0,09% a 5,63±0,01% en hojas deshidratadas. Los resultados referidos a la deshidratación donde se aprecian diferencias entre fresco y secado a 55 °C se corresponden a lo citado por Makkar (2003), por lo que, a la hora de hacer comparaciones, se debe conocer el tratamiento que se le dio a la muestra al ser procesada para medir los compuestos secundarios presentes, ya que las diferencias son importantes.
Las figuras 1 al 5 se muestran los valores para cada uno de los grupos de compuestos determinados, contras-tando determinación en fresco y en seco a 55 °C, junto con sus respectivas desviaciones estándar, pudiendo percatarse de que las mayores desviaciones ocurrieron en los fenoles simples (Figura 1), probable-mente asociado a las variaciones en madurez de las hojas en crecimiento y a la volatilidad de los fenoles simples, aunque se repite en las figuras 2, 3 y 4, donde probablemente la madurez pudo afectar más que la volatilidad, lo contrario ocurrió con los taninos condensables (Figura 4) para la etapa de crecimiento activo, lo cual pudiese explicarse por la posibilidad de su transformación en medio húmedo, afectada por la variación en madurez de la fibra en crecimiento, como lo reporta Makkar (2003).
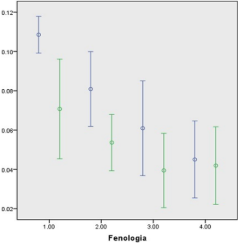
Figura 1. Fenoles simples (%) en follaje fresco (azul) o seco (verde) de la Acacia polyphylla en los estados fenológicos 1: Crecimiento activo; 2: Prefloración; 3: Floración; 4: Fructificación.
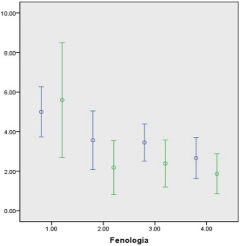
Figura 2. Polifenoles totales (%) en follaje fresco (azul) o seco (verde) de la Acacia polyphylla en los estados fenológicos 1: Crecimiento activo; 2: Prefloración; 3: Floración; 4: Fructificación.
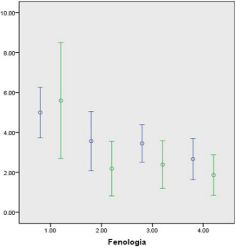
Figura 3. Taninos totales (%) en follaje fresco (azul) o seco (verde) de la Acacia polyphylla en los estados fenológicos 1: Crecimiento activo; 2: Prefloración; 3: Floración; 4: Fructificación.
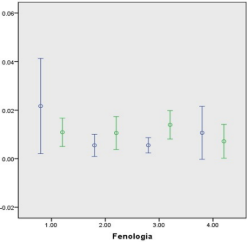
Figura 4. Taninos Condensables (%) en follaje fresco (azul) o seco (verde) de la Acacia polyphylla en los estados) fenológicos 1: Crecimiento activo; 2: Prefloración; 3: Floración; 4: Fructificación.
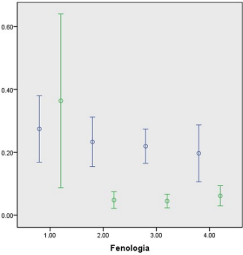
Figura 5. Taninos que precipitan proteínas (%) en follaje fresco (azul) o seco (verde) de la Acacia polyphylla en los estados fenológicos 1: Crecimiento activo; 2: Prefloración; 3: Floración; 4: Fructificación.
Calderón (2006) reporta niveles semejantes, dentro de los rangos de variación reportados, para polifenoles simples, taninos totales y taninos condensables en las etapas de fructificación y crecimiento activo, en plantas que crecieron en condiciones muy similares, pero en años y plantas diferentes y con muestras deshidratadas a 55 °C, las deviaciones estándar reportadas por la autora son también semejantes, lo que puede indicar variaciones entre plantas utilizadas, sea por el suelo, edad o densidad vegetal donde crece. Gowda & Palo (2003) consiguieron un patrón similar de concentraciones de polifenoles y taninos en Acacia tortilis, donde la madurez de las hojas incrementó su concentración, aunque para dicha especie los valores de taninos condensables fueron muy superiores (1,17±0,19%). El hecho de que, en fructificación, todos los compuestos determinados tuvieron los niveles más bajos, tiene implicaciones importantes: primero, respecto a la planta, que facilita la propagación de sus semillas; segundo, es el momento donde es mayor la factibilidad de ser utilizada en alimentación de herbívoros con menor riesgo de afectar el consumo y digestibilidad de los nutrientes por causas de los compuestos secundarios; y si a eso se le añade, que el proceso de secado disminuye aún más la mayoría de los compuestos secundarios, sería una posible práctica de conservación de forrajes el secado para almacenar en forma de heno, gránulos o harinas. Esto coincide con lo reportado por Espejo-Díaz & Nouel-Borges (2014; 2020) donde el remojo con tratamiento térmico tanto en hojas como en vainas de Acacia macracantha disminuyó significativamente el contenido y efecto negativo de estos compuestos secundarios en dietas para conejos, alcanzando niveles de crecimiento similares a los de dietas comerciales a incorporar hasta 30% de materia seca de hojas o vainas tratadas térmicamente y remojadas.
La Acacia polyphylla es una leguminosa que puede tener de 13,9±3,99% a 21,4±1,87% de proteína cruda y 67,5±1,73% a 83,2±5,22% de pared celular en sus hojas (secas al sol o frescas, respectivamente; Nouel-Borges, 2015), por lo cual tiene un gran potencial como especie forrajera para ambientes semiáridos y del bosque seco y muy seco tropical. Conocer cómo cambia la composición de los compuestos secundarios, taninos y fenoles específicamente, con sus estados fenológicos, pueden servir como referencia para su aprovechamiento dentro de sistemas Agroforestales y Silvopastoriles, ya que su adaptabilidad a estos ambientes la puede presentar como una alternativa resiliente al cambio climático. Los niveles de estos compuestos secundarios en hojas son inferiores a los reportados para Acacia macracantha (Nouel-Borges, 2015), Acacia nilotica (Swati et al., 2021), Acacia tortilis (Gowda & Palo, 2003), sosteniendo la posibilidad de ser aprovechada por pequeños rumiantes, lagomorfos, camélidos y venados si se le da el manejo adecuado.
- Conclusiones
Las hojas de Acacia polyphylla, presentan diferente contenido de taninos y polifenoles en los cuatro estados fenológicos estudiados. En el estado fenológico de crecimiento activo se obtuvieron, los mayores niveles de todos los compuestos, observándose una disminución progresiva a medida que la planta madura. El tratamiento térmico a 55 ºC por 48 horas; redujo considerablemente la cantidad de fenoles simples, y ocasionó una pequeña reducción en el contenido de taninos totales, polifenoles totales y taninos precipitables; pero no afectó el contenido de taninos condensables.
Agradecimientos
Al CDCHT de la Universidad Centroccidental Lisandro Alvarado por el financiamiento total de la presente investigación mediante le proyecto 009-AG-2006.
Referencias bibliográficas
Araujo Filho, J. A. de, Carvalho, F. C. de, & Silva, N. L. da. (2002). Fenología y valor nutritivo de follajes de algunas especies forrajeras de la Caatinga. Agroforestería en las Américas, 9, 33-37.
Brooks, R., & Owen-Smith, N. (1994). Plant defences against mammalian herbivores: ¿are juvenile Acacia more heavily defended than mature trees? Bothalia, 24(2), 211-215. https://doi.org/10.4102/abc.v24i2.773
Calderón Salas, M. (2006). Extracción y caracterización de compuestos polifenólicos, presentes en Acacia polyphylla y Mimosa arenosa, especies leguminosas nativas del semiárido Estado Lara. [Trabajo Especial presentado ante el Departamento de Ingeniería Química de la Universidad Nacional Experimental Politécnica “Antonio José de Sucre” Vice-Rectorado de Barquisimeto como requisito parcial para optar al Título de Ingeniero Químico]. 97 p.
Cesarino, E. C., dos S. Gomes, J. O., Lessa, E. V., de Carvalho, A. R., Vieira, I. J. C., de Carvalho, M. G., da Silva, T. M. S., (...), & Ferreira, R. O. (2020). Composição Química e Atividade Antioxidante de Acacia polyphylla (Fabaceae). Rev. Virtual Quim., 12(2), 424-432. http://dx.doi.org/10.21577/1984-6835.20200034
Chavan, U., Shahidi, F., & Naczk, M. (2001). Extraction of condensed tannins from beach pea (Lathyrus maritimus L.) as affected by different solvents. Food Chemistry, 75(4), 509-512. https://doi.org/10.1016/S0308-8146(01)00234-5
Espejo-Díaz, M.A., and Nouel-Borges, G. E. (2020). Evaluation of Acacia macracantha pods in balanced ration for growing rabbits. Agronomía Costarricense, 44(1), 93-104. http://dx.doi.org/10.15517/rac.v44i1.40005
Espejo-Díaz, M.A., & Nouel-Borges, G. E. (2014). Secondary compounds attenuation in Acacia macracantha leaves and its effect on intake, digestibility, plasma and productive variables by incorporating them in rations for rabbits. Animal Production Science, 55(2), 237-240. http://dx.doi.org/10.1071/AN14142
Gowda, J. H., & Palo, R.T. (2003). Age-related changes in defensive traits of Acacia tortilis. Hayne, 41(3), 218-223. https://doi.org/10.1046/j.1365-2028.2003.00434.x
Joint FAO/IAEA. (2000). Quantification of tannins in tree foliage. A laboratory manual for the FAO/IAEA coordinated research project on 'Use of nuclear and related techniques to develop simple tannin assays for predicting and improving the safety and efficiency of feeding ruminants on tanniniferous tree foliage' (INIS-XA-553). Division of Nuclear Techniques in Food and Agriculture, Vienna (Austria) International Atomic Energy Agency (IAEA)
Makkar, H. P. S., Bluemmel, M., Borowy, N. K., & Becker, K. (1993). Gravimetric determination of tannins and their correlations with chemical and protein precipitation methods. Journal of Science Food Agriculture, 61, 161-165. https://doi.org/10.1002/jsfa.2740610205
Makkar, H. P. S, Dawra, R. K., & Singh, B. (1988). Determination of both tannin and protein in a tannin-protein complex. Journal Agriculture Food Chemistry, 36, 523-525.
Martínez, B., Rincón, F., & Ibáñez, M. (2000). Optimization of Tannin Extraction from Infant Foods. J. Agric. Food Chem., 48(6), 2097-2100. https://doi.org/10.1021/jf991267o
Nouel-Borges, G. (2015). Leguminosas Tropicales del Semiárido y Alternativas de Uso en Alimentación de Herbívoros. Saarbrücken, Germany. Editorial Académica Española, 124 p.
Ortiz, J. N., Miranda, H., & Peroza, D. (2015). Uniformidad y pérdidas por evaporación y arrastre en riego por aspersión en Tarabana, estado Lara. Revista Unellez de Ciencia y Tecnología, 33, 53-61.
Parissi, Z. M., Karameri E., Abraham E. M., Kyriazopoulos A. P., and Petridis, A. (2014). Impact of maturation on extractable polyphenols in leguminous fodder species. In: Baumont R. et al. Forage resources and ecosystem services provided by Mountain and Mediterranean grasslands and rangelands. Zaragoza: CIHEAM/INRA/FAO/VetAgro Sup Clermont-Ferrand / Montpellier SupAgro, Options Méditerranéennes: Série A. Séminaires Méditerranéens, 109, 219-222.
Pirie, N. W. (2008). Leaf Protein and its by-products in human and animal nutrition. 2nd revised edition Cambridge University Press, Cambridge CB2 8RU, UK, 224 p.
Porter, L. J., Hrstich, L. N., & Chan, B. G. (1986). The conversion of procyanidins and prodelphinidins to cyanidin and delphinidin (online). Phytochemistry, 25, 223-230.
Rico, M. (2001). El Género Acacia (Leguminosae, Mimosoiedeae) en el Estado de Oaxaca, México. Anales del Jardín Botánico de Madrid, 58(2), 251-302. https://doi.org/10.3989/ajbm.2000.v58.i2.157
SPSS Inc. Released (2009). PASW Statistics for Windows, Version 18.0. Chicago: SPSS Inc.
Statistix For Windows. (2003). Version 8.0. Analytical Software.
Swati Gautam, S., Swapandeep Singh, C., Saroj, A., & Satwinder Kaur, S. (2021). Toxic effects of purified phenolic compounds from Acacia nilotica against common cutworm. Toxicon, 203, 22-29 https://doi.org/10.1016/j.toxicon.2021.09.017.
Torregrossa, A.-M., & Dearing, M.D. (2009). Nutritional toxicology of mammals: regulated intake of plant secondary compounds. Functional Ecology, 23, 48–56. https://doi.org/10.1111/j.1365-2435.2008.01523.x
Ung, A. T., & Asmara, A. P. (2023). Bioactive Phytochemicals of Acacia saligna. Molecules, 28, 4396. https://doi.org/10.3390/molecules28114396
Yáñez-Ruiz D. R., & Belanche, A. (2020). Plant secondary compounds: beneficial roles in sustainable ruminant nutrition and productivity. Chapter. Burleigh Dodds Science Publishing Limited. All rights reserved. http://dx.doi.org/10.19103/AS.2020.0067.25
Wink, M. (2013). Evolution of secondary metabolites in legumes (Fabaceae). South African Journal of Botany, 89, 164–175. http://dx.doi.org/10.1016/j.sajb.2013.06.006