- Efectos biofuncionales y acción antimicrobiana
Los compuestos fenólicos vegetales, particularmente flavonoides, ácidos fenólicos y antocianinas, han demostrado poseer notables propiedades biofun-cionales que los convierten en componentes prometedores para aplicaciones nutracéuticas y alimentarias. Estos metabolitos secundarios ejercen su acción antioxidante mediante múltiples mecanismos: donación de electrones/protones para neutralizar radicales libres, quelación de metales de transición que catalizan reacciones de peroxidación, y regulación de enzimas antioxidantes endógenas (Marković et al., 2025). Paralelamente, su actividad antimicrobiana deriva de su capacidad para interaccionar con membranas celulares bacterianas, alterando su potencial de membrana y permeabilidad, e inhibiendo enzimas clave en rutas metabólicas microbianas (Mohammadi et al., 2016).
No obstante, la aplicación directa de estos compuestos enfrenta importantes limitaciones tecnológicas. La presencia de grupos hidroxilo fenólicos altamente reactivos los hace susceptibles a degradación oxidativa, fotoisomerización e inactivación enzimática durante el procesamiento, almacenamiento y tránsito gastrointestinal. Esta inestabilidad intrínseca reduce significativamente su biodisponibilidad y eficacia biológica in vivo. La encapsulación emerge como solución estratégica, permitiendo proteger los compuestos bioactivos mediante su confinamiento en matrices poliméricas que actúan como barreras físicas contra factores ambientales adversos (Radünz et al., 2021).
En la Figura 2 se resumen los principales mecanismos biofuncionales de los compuestos fenólicos, las barreras tecnológicas que limitan su eficacia y los beneficios derivados de su encapsulación como estrategia de estabilización y liberación controlada.
La literatura científica reciente documenta casos paradigmáticos del efecto potenciador de la encapsulación. En el ámbito antioxidante, la nanoencapsulación de extracto de cantalupo en nanopartículas híbridas de proteína de suero (WPI) y aislado proteico de soya (SPI) logró reducir el tamaño de partícula a <100 nm, incrementando la eficiencia de encapsulación hasta 91% y multiplicando por seis la actividad captadora de radicales DPPH respecto al extracto libre (da Silva et al., 2025). Este fenómeno se atribuye al efecto protector de la matriz proteica sobre los grupos fenólicos y al aumento del área superficial específica en la nanoescala. Estudios similares con microcápsulas de extracto de cubierta de soja (obtenidas por spray-drying con maltodextrina) demostraron reducciones del IC₅₀ en ensayos DPPH (de 85 a 52 µg mL⁻¹) y mejoras del 28% en capacidad ABTS, evidenciando la preservación de la actividad redox (Bergesse et al., 2023). Ensayos paralelos con nanoemulsiones de polifenoles de Eryngium campestre mostraron incrementos significativos en la estabilidad oxidativa de aceites modelo, subrayando el rol protector de las nanoestructuras (Azizkhani & Sodanlo, 2021).
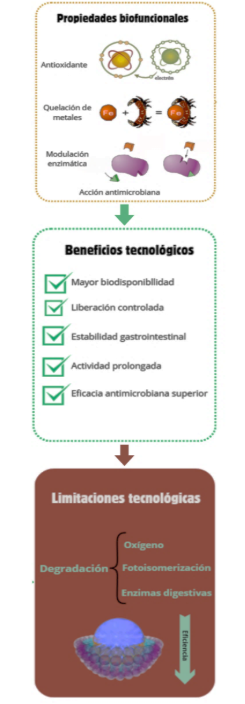
Figura 2. Mecanismos biofuncionales de los compuestos fenólicos y beneficios tecnológicos de su encapsulación frente a limitaciones de estabilidad.
En el contexto antimicrobiano, los sistemas encap-sulados muestran ventajas comparativas significa-tivas. Investigaciones con ultrafibras de almidón cargadas con extracto de cutícula de Araucaria angustifolia reportaron valores MIC de 250 µg mL⁻¹ contra Staphylococcus aureus y Escherichia coli, la mitad de la concentración requerida por el extracto libre (Fonseca et al., 2020). Esta potenciación se explica por la liberación controlada y dirigida de los principios activos en el sitio de acción. Sistemas más complejos, como liposomas recubiertos con quitosano cargados con polifenoles de desechos de piña, combinaron la acción antimicrobiana intrínseca del biopolímero catiónico con la actividad de proantocianidinas, logrando inhibición completa de S. aureus en modelos de cultivo (Bassan et al., 2025).
Los estudios de digestión gastrointestinal simulada han aportado evidencias contundentes sobre las ventajas de la encapsulación. Microcápsulas de antocianinas de arándano (formuladas con aislado de soya y gelatina) no solo protegieron los pigmentos durante la fase gástrica, sino que incrementaron su liberación en condiciones colónicas (pH 7), favoreciendo su fermentación por microbiota intestinal. Este proceso generó un perfil microbiano con predominio de Bacteroidetes sobre Firmicutes, asociado a efectos metabólicos beneficiosos (Han et al., 2022).
A nivel de mecanismos de acción, investigaciones con cultivos celulares Caco-2 han revelado que micro-cápsulas de quercetina reducen en un 40% la generación de especies reactivas de oxígeno inducida por estrés oxidativo, confirmando su efecto cito-protector (Tranquilino et al., 2021). En aplicaciones industriales, destacan desarrollos como leches fermentadas enriquecidas con catequinas encap-suladas y películas comestibles con quercetina microencapsulada que extendieron la vida útil de queso fresco al inhibir el crecimiento superficial de S. aureus (Pereira et al., 2018).
- Tecnologías de encapsulación adaptadas a fenoles termolábiles
Los fenoles termolábiles, entre ellos catequinas, antocianinas y flavonoles metoxilados, sufren oxidación, isomerización y ruptura de enlaces glicosídicos incluso a temperaturas moderadas, lo que limita su incorporación directa en matrices alimentarias sometidas a procesos térmicos (Marković et al., 2025). Por ello, se requieren tecnologías de encapsulado que operen a baja temperatura o que garanticen tiempos de residencia térmica mínimos, sin comprometer la integridad química del núcleo activo (Veggi et al., 2023).
Una estrategia consolidada es la encapsulación, es la separación en fluidos supercríticos (SFE). Bajo condiciones de 35 – 40 MPa y 45 °C, se obtiene simultáneamente la extracción selectiva y la precipitación controlada de fenoles, produciendo microcápsulas de alta pureza y tamaños de partícula entre 0,7 y 2 µm, con eficiencias de encapsulación superiores al 80% y sin residuos orgánicos (Alemán et al., 2019). La baja temperatura del proceso preserva la estructura de ácidos fenólicos sensibles, y la rápida expansión del CO₂ actúa como barrera frente a la oxidación (Liew et al., 2020).
El spray freeze-drying y la liofilización convencional constituyen alternativas de deshidratación a bajas temperaturas. En liposomas de fosfatidilcolina cargados con extractos fenólicos, la liofilización mantuvo la actividad antioxidante en un 65% y conservó la funcionalidad coloidal, con diámetros finales de 310 ± 12 nm y potencial zeta estable (-31 mV) (Rafiee et al., 2017). Paralelamente, microemul-siones de quitosano–maltodextrina sometidas a congelación instantánea y posterior sublimación lograron EE del 91%, redujeron la higroscopicidad del polvo y limitaron la degradación de antocianinas púrpura a < 8% tras 90 d de almacenamiento a 4 °C (Mohammadi et al., 2016).
Las técnicas sin aporte térmico directo, como el electrohilado y la formación de Pickering emulsions, emergen como plataformas promisorias. Fibras ultrafinas de almidón cargadas con extractos de fenoles mostraron retención de actividad antioxidante superior al 90 % después de tratamientos térmicos de 180 °C aplicados sobre la matriz alimentaria final, gracias a la rápida evaporación del disolvente y a la nanoescala de las fibras (Fonseca et al., 2020). Por su parte, microcápsulas obtenidas por coacervación compleja gelatina–goma arábiga encapsularon proantocianidinas con EE del 79%, incrementaron la estabilidad térmica (Tmax DSC 147 °C) y mantuvieron la intensidad de color en helados sometidos a ciclos de congelación/descongelación (Brito de Souza et al., 2020).
Como se resume en la Tabla 2, las tecnologías de encapsulación adaptadas a fenoles termolábiles se diferencian tanto en sus condiciones operativas como en sus ventajas técnicas, eficiencia de encapsulación y viabilidad industrial. Esta comparación permite identificar opciones adecuadas según la sensibilidad térmica del compuesto fenólico y las exigencias del producto final.
Desde la perspectiva de escalabilidad, el SFE presenta inversiones iniciales altas, pero reduce el consumo de solventes y el tiempo de secado; el costo operativo estimado de US$ 12 – 24 kg⁻¹ de extracto resulta competitivo frente a secado por vacío cuando se incluyen gastos de solvente y reprocesos por degradación térmica. El spray freeze-drying, aunque más costoso en energía que el spray-drying convencional, ofrece rendimientos comparables (> 60%) y polvos con solubilidad instantánea (Azizkhani & Sodanlo, 2021), mientras que el electrohilado compite por su bajo consumo energético (≈ 0,5 kWh kg⁻¹) y fácil acoplamiento a sistemas continuos de dosificación (Fonseca et al., 2020). Estas tecnologías, en conjunto, consolidan un portafolio versátil para la protección de fenoles termolábiles y la creación de ingredientes funcionales de alta estabilidad destinados a la industria alimentaria y nutracéutica peruana.
- Portadores naturales y sostenibles para la preservación de extractos fenólicos
El diseño de micro- y nanoestructuras “clean-label” se sustenta en biopolímeros renovables que, además de ser GRAS, permiten valorizar subproductos agrícolas y reducir la huella ambiental de los ingredientes funcionales (Tomé & da Silva, 2022). Entre los portadores más extendidos destacan los polisacáridos de bajo costo y elevada compatibilidad con com-puestos fenólicos. Combinaciones de maltodextrina y goma arábiga obtenidas por spray-drying alcanzan eficiencias de encapsulación del 98% al proteger extractos de orujo de uva y mantienen la estabilidad fenólica durante 90 días de refrigeración en yogur griego (Marković et al., 2025; Pilatti et al., 2019). De forma complementaria, las microesferas de alginato enriquecidas con inulina incrementan la EE de antioxidantes en bayas amazónicas y generan partículas de 0,8 – 1,1 mm que liberan los fenoles de forma sostenida en digestión simulada (Zorzenon et al., 2020). Estas matrices vegetales muestran baja higroscopicidad y buena solubilidad instantánea, atributos apreciados por la industria de bebidas en polvo (Chabni et al., 2025).
Los portadores proteicos añaden funcionalidad emulsificante y mejoran la bioaccesibilidad intestinal. Las nanoemulsiones quitosano-maltodextrina reducen el tamaño hasta 16 nm y elevan la EE al 91%, a la vez que confieren estabilidad oxidativa a extractos polifenólicos de Eryngium campestre (Azizkhani & Sodanlo, 2021). De forma análoga, microcápsulas de antocianinas de arándano con aislado de soya modulaban positivamente el microbiota colónico tras fermentación in vitro, indicando un potencial sinérgico prebiótico-polifenol (Han et al., 2022).
Diversos estudios han empleado biopolímeros renovables y compatibles con extractos fenólicos para el desarrollo de sistemas de encapsulación funcionales y sostenibles. La Tabla 3 presenta una selección representativa de combinaciones de portadores, sus técnicas asociadas y los beneficios funcionales observados en cada caso.
- Perspectivas futuras y oportunidades para mejorar la encapsulación de fenoles
El análisis bibliométrico realizado en esta revisión reveló no solo el crecimiento sostenido del interés científico en la encapsulación de compuestos fenólicos, sino también vacíos significativos en su aplicación práctica, particularmente en especies peruanas emergentes. Estas limitaciones abren oportunidades para la innovación, tanto desde el punto de vista tecnológico como socioeconómico, con gran potencial para el sector agroindustrial nacional y el desarrollo de alimentos funcionales sostenibles.
- Evaluación de la bioaccesibilidad y biodisponibilidad clínica
Uno de los principales desafíos detectados es la falta de estudios que evalúen la bioaccesibilidad y biodisponibilidad in vivo de los compuestos fenólicos encapsulados, especialmente en matrices alimentarias complejas. La mayoría de investigaciones en especies como mashua negra (Tropaeolum tuberosum) y cañihua (Chenopodium pallidicaule) se ha restringido a modelos in vitro, lo cual no es suficiente para predecir la efectividad clínica real de los extractos (Coloma et al., 2022; Ortiz et al., 2024).
Estudios recientes destacan que la encapsulación puede modificar positivamente la liberación colónica de polifenoles, mejorando su fermentación por el microbiota intestinal y prolongando su acción antioxidante o antiinflamatoria (Han et al., 2022). Por ello, futuros ensayos clínicos y simulaciones gastrointestinales dinámicas deben priorizarse para validar los beneficios biofuncionales, tal como se ha hecho con otros ingredientes activos en alimentos funcionales (Villanueva, 2025).
- Escalamiento industrial y validación tecnológica
Otro punto crítico es la necesidad de validar la escalabilidad industrial de las técnicas de encapsulación que han demostrado eficacia en laboratorio. Por ejemplo, la separación en fluidos supercríticos (SFE) con CO₂ ha mostrado resultados prometedores en la encapsulación de flavonoides de guama (Inga edulis), pero su implementación a escala industrial aún enfrenta barreras relacionadas con el costo del equipo, eficiencia energética y control del proceso (Liew et al., 2020; Veggi et al., 2023).
Además, se deben considerar las condiciones reales de operación en la agroindustria peruana, donde la disponibilidad tecnológica y la inversión inicial son variables limitantes. Es necesario desarrollar estudios de análisis de ciclo de vida (ACV) y análisis de costo-beneficio que evalúen la viabilidad técnica, económica y ambiental del escalado (Hunsub et al., 2025). Solo así será posible trasladar estas tecnologías a cadenas productivas locales, como las de superalimentos y productos nutracéuticos.
- Portadores sostenibles de origen local
Una de las oportunidades más prometedoras identificadas es el aprovechamiento de subproductos agroindustriales como matrices encapsulantes, lo cual permitiría reforzar el enfoque sustentable de la encapsulación. Residuos como cáscaras de mango, bagazo de caña, semillas de palta o mucílago de tuna poseen propiedades tecnofuncionales valiosas (fibra dietética, polisacáridos, compuestos gelificantes) que pueden utilizarse para diseñar portadores biodegradables y funcionales (Chauhan & Rao, 2024; Marković et al., 2025).
El uso de estos subproductos también fortalece la economía circular, reduce el impacto ambiental y disminuye los costos de producción, al tiempo que mejora la imagen “clean-label” de los productos finales (Chauhan & Rao, 2024). De esta manera, las investigaciones futuras deberían focalizarse en caracterizar y validar nuevos portadores naturales procedentes de residuos agroindustriales locales.
- Integración en matrices alimentarias funcionales
Pese al avance en tecnologías de encapsulación, aún son escasos los estudios que integren extractos fenólicos encapsulados en productos alimentarios finales y evalúen su estabilidad durante el proce-samiento, almacenamiento y consumo. Productos como leches fermentadas, barras energéticas, panes integrales o bebidas funcionales pueden ser vehículos eficientes para estos compuestos, pero requieren validación sensorial, fisicoquímica y funcional (Azizkhani & Sodanlo, 2021; Ozgolet et al., 2025)
Además, sería pertinente evaluar la interacción de los fenoles encapsulados con otros ingredientes funcionales, como prebióticos, probióticos o péptidos bioactivos. Esto permitiría diseñar alimentos sinérgicos con mayor impacto sobre la salud intestinal, metabólica e inmunológica. La tendencia actual del mercado nutracéutico valora este tipo de combinaciones, especialmente en segmentos como el antiaging, salud cardiovascular y digestiva (Bassan et al., 2025).
- Conclusiones
El presente estudio revela tendencias claras y vacíos críticos aún por atender. Se confirma que técnicas como el spray-drying y la nanoencapsulación dominan el campo, destacando por su eficiencia y adapta-bilidad, especialmente cuando se utilizan matrices naturales “clean-label” como maltodextrina, goma arábiga y quitosano. Este hallazgo es relevante para la valorización de subproductos agroindustriales como portadores sostenibles. Los resultados más prometedores se obtuvieron en especies como el algarrobo (Prosopis pallida), que alcanzó una eficiencia de encapsulación del 92% y retención antioxidante superior al 85%, y la guama (Inga edulis), cuyo tratamiento con CO₂ supercrítico redujo las pérdidas de fenoles a menos del 5%. Asimismo, la mashua negra (Tropaeolum tuberosum) conservó el 88% de su capacidad FRAP tras liofilización, y la cañihua (Chenopodium pallidicaule), encapsulada en nanoemulsiones estabilizadas con quitosano, mejoró significativamente su bioaccesibilidad intestinal sin afectar la calidad sensorial del producto final. Pese a estos avances, persisten vacíos importantes en la evaluación de la biodisponibilidad clínica, la integración de estos sistemas en matrices alimentarias reales y el escalamiento industrial de tecnologías como el uso de fluidos supercríticos. Además, se identifican oportunidades estratégicas en el desarrollo de ingredientes funcionales con identidad peruana, sustentados en evidencia científica robusta, matrices locales y bajo impacto ambiental. Esta revisión subraya la urgencia de consolidar líneas de investigación orientadas al desarrollo de sistemas encapsulados eficientes, sostenibles y clínicamente validados, lo cual resulta clave para fortalecer la agroindustria peruana en el mercado global de alimentos funcionales.
Referencias bibliográficas
Alemán, A., Marín, D., Taladrid, D., Montero, P., & Carmen Gómez-Guillén, M. (2019). Encapsulation of antioxidant sea fennel (Crithmum maritimum) aqueous and ethanolic extracts in freeze-dried soy phosphatidylcholine liposomes. Food Research International, 119, 665-674. https://doi.org/10.1016/j.foodres.2018.10.044
Azizkhani, M., & Sodanlo, A. (2021). Antioxidant activity of Eryngium campestre L., Froriepia subpinnata, and Mentha spicata L. polyphenolic extracts nanocapsulated in chitosan and maltodextrin. Journal of Food Processing and Preservation, 45(2). https://doi.org/10.1111/jfpp.15120
Bassan, L. T., Nascimento, K. R., Choquetico Iquiapaza, I. Y., da Silva Ferreira, M. E., Tapia-Blacido, D. R., Fabi, J. P., & Martelli-Tosi, M. (2025). Chitosan suspension enriched with phenolics extracted from pineapple by-products as bioactive coating for liposomes: Physicochemical properties and in vitro cytotoxicity. Food Research International, 201. https://doi.org/10.1016/j.foodres.2024.115571
Bergesse, A. E., Asensio, C. M., Quiroga, P. R., Ryan, L. C., Grosso, N. R., & Nepote, V. (2023). Microencapsulation of phenolic compounds extracted from soybean seed coats by spray-drying. Journal of Food Science, 88(11), 4457-4471. https://doi.org/10.1111/1750-3841.16775
Brito de Souza, V., Thomazini, M., Chaves, I. E., Ferro-Furtado, R., & Favaro-Trindade, C. S. (2020). Microencapsulation by complex coacervation as a tool to protect bioactive compounds and to reduce astringency and strong flavor of vegetable extracts. Food Hydrocolloids, 98. https://doi.org/10.1016/j.foodhyd.2019.105244
Castañeta, G., Miranda-Flores, D., Bascopé, M., & Peñarrieta, J. M. (2024). Characterization of carotenoids, proximal analysis, phenolic compounds, anthocyanidins and antioxidant capacity of an underutilized tuber (Tropaeolum tuberosum) from Bolivia. Discover Food, 4(1). https://doi.org/10.1007/s44187-024-00078-8
Chabni, A., Bañares, C., Sanchez-Rey, I., & Torres, C. F. (2025). Active Biodegradable Packaging Films Based on the Revalorization of Food-Grade Olive Oil Mill By-Products. Applied Sciences, 15(1), Article 1. https://doi.org/10.3390/app15010312
Chauhan, K., & Rao, A. (2024). Clean-label alternatives for food preservation: An emerging trend. Heliyon, 10(16). https://doi.org/10.1016/j.heliyon.2024.e35815
Chen, X., Chhun, S., Xiang, J., Tangjaidee, P., Peng, Y., & Quek, S. Y. (2021). Microencapsulation of Cyclocarya paliurus (Batal.) iljinskaja extracts: A promising technique to protect phenolic compounds and antioxidant capacities. Foods, 10(12). https://doi.org/10.3390/foods10122910
Chirinos, R., Pedreschi, R., Cedano, I., & Campos, D. (2015). Antioxidants from Mashua (Tropaeolum tuberosum) Control Lipid Oxidation in Sacha Inchi (Plukenetia volubilis L.) Oil and Raw Ground Pork Meat. Journal of Food Processing and Preservation, 39(6), 2612-2619. https://doi.org/10.1111/jfpp.12511
Coloma, A., Flores-Mamani, E., Quille-Calizaya, G., Zaira-Churata, A., Apaza-Ticona, J., Calsina-Ponce, W. C., Huata-Panca, P., Inquilla-Mamani, J., & Huanca-Rojas, F. (2022). Characterization of Nutritional and Bioactive Compound in Three Genotypes of Mashua (Tropaeolum tuberosum Ruiz and Pavón) from Different Agroecological Areas in Puno. International Journal of Food Science, 2022. https://doi.org/10.1155/2022/7550987
da Silva, T. E. B., de Oliveira, Y. P., de Carvalho, L. B. A., dos Santos, J. A. B., dos Santos Lima, M., Fernandes, R., de Assis, C. F., & Passos, T. S. (2025). Nanoparticles based on whey and soy proteins enhance the antioxidant activity of phenolic compound extract from Cantaloupe melon pulp flour (Cucumis melo L.). Food Chemistry, 464. https://doi.org/10.1016/j.foodchem.2024.141738
de Freitas, F. A., Araújo, R. C., Soares, E. R., Nunomura, R. C. S., da Silva, F. M. A., da Silva, S. R. S., de Souza, A. Q. L., de Souza, A. D. L., Franco-Montalbán, F., Acho, L. D. R., Lima, E. S., Bataglion, G. A., & Koolen, H. H. F. (2018). Biological evaluation and quantitative analysis of antioxidant compounds in pulps of the Amazonian fruits bacuri (Platonia insignis Mart.), ingá (Inga edulis Mart.), and uchi (Sacoglottis uchi Huber) by UHPLC-ESI-MS/MS. Journal of Food Biochemistry, 42(1). https://doi.org/10.1111/jfbc.12455
Fonseca, L. M., Radünz, M., dos Santos Hackbart, H. C., da Silva, F. T., Camargo, T. M., Bruni, G. P., Monks, J. L. F., da Rosa Zavareze, E., & Dias, A. R. G. (2020). Electrospun potato starch nanofibers for thyme essential oil encapsulation: Antioxidant activity and thermal resistance. Journal of the Science of Food and Agriculture, 100(11), 4263-4271. https://doi.org/10.1002/jsfa.10468
Gonzales, U., Dijkshoorn, R., Maloncy, M., Finimundy, T., Calhelha, R. C., Pereira, C., Stojković, D., Soković, M., Ferreira, I. C. F. R., Barros, L., & Cadavez, V. (2020). Nutritive and bioactive properties of mesquite (Prosopis pallida) flour and its technological performance in breadmaking. Foods, 9(5). https://doi.org/10.3390/foods9050597
Han, Q., Zhang, X., Nian, H., Liu, H., Li, X., Zhang, R., & Bao, J. (2022). Artificial rearing alters intestinal microbiota and induces inflammatory response in piglets. Frontiers in Microbiology, 13. https://doi.org/10.3389/fmicb.2022.1002738
Hunsub, P., Ngamprasertsith, S., Prichapan, N., Sakdasri, W., Karnchanatat, A., & Sawangkeaw, R. (2025). Life cycle assessment of spray-drying encapsulation of crude peptides produced from defective green coffee beans. Clean Technologies and Environmental Policy, 27(3), 1535-1550. https://doi.org/10.1007/s10098-024-02913-z
Liew, S. Y., Mohd Zin, Z., Mohd Maidin, N. M., Mamat, H., & Zainol, M. K. (2020). Effect of the different encapsulation methods on the physicochemical and biological properties of Clitoria ternatea flowers microencapsulated in gelatine. Food Research, 4(4), 1098-1108. https://doi.org/10.26656/fr.2017.4(4).033
Marković, J., Salević-Jelić, A., Milinčić, D., Gašić, U., Pavlović, V., Rabrenović, B., Pešić, M., Lević, S., Mihajlović, D., & Nedović, V. (2025). Horseradish (Armoracia rusticana L.) leaf juice encapsulated within polysaccharides-blend-based carriers: Characterization and application as potential antioxidants in mayonnaise production. Food Chemistry, 464. https://doi.org/10.1016/j.foodchem.2024.141777
Mohammadi, A., Jafari, S. M., Esfanjani, A. F., & Akhavan, S. (2016). Application of nano-encapsulated olive leaf extract in controlling the oxidative stability of soybean oil. Food Chemistry, 190, 513-519. https://doi.org/10.1016/j.foodchem.2015.05.115
Ortiz, J., Ibieta, G., Tullberg, C., Peñarrieta, J. M., & Linares-Pastén, J. A. (2024). Chemical Characterisation of New Oils Extracted from Cañihua and Tarwi Seeds with Different Organic Solvents. Foods, 13(13). https://doi.org/10.3390/foods13131982
Ozgolet, M., Belkacemi, L., & Arici, M. (2025). Enhancing the nutritional and textural properties of gluten-free shortbread biscuits: The potential of white-fleshed sweet potato flour blended with corn starch. Journal of Food Science, 90(3). https://doi.org/10.1111/1750-3841.70123
Pereira, M. C., Oliveira, D. A., Hill, L. E., Zambiazi, R. C., Borges, C. D., Vizzotto, M., Mertens-Talcott, S., Talcott, S., & Gomes, C. L. (2018). Effect of nanoencapsulation using PLGA on antioxidant and antimicrobial activities of guabiroba fruit phenolic extract. Food Chemistry, 240, 396-404. https://doi.org/10.1016/j.foodchem.2017.07.144
Pilatti, D., dos Santos, D. F., Meinhart, A. D., Knapp, M. A., Hackbart, H. C. D. S., & Pinto, V. Z. (2019). Impact of the use of saccharides in the encapsulation of Ilex paraguariensis extract. Food Research International, 125. https://doi.org/10.1016/j.foodres.2019.108600
Quispe, C., Petroll, K., Theoduloz, C., & Schmeda-Hirschmann, G. (2014). Antioxidant effect and characterization of South American Prosopis pods syrup. Food Research International, 56, 174-181. https://doi.org/10.1016/j.foodres.2013.12.033
Radünz, M., Mota Camargo, T., dos Santos Hackbart, H. C., Blank, J. P., Hoffmann, J. F., Moro Stefanello, F., & da Rosa Zavareze, E. (2021). Encapsulation of broccoli extract by electrospraying: Influence of in vitro simulated digestion on phenolic and glucosinolate contents, and on antioxidant and antihyperglycemic activities. Food Chemistry, 339. https://doi.org/10.1016/j.foodchem.2020.128075
Rafiee, Z., Barzegar, M., Sahari, M. A., & Maherani, B. (2017). Nanoliposomal carriers for improvement the bioavailability of high – valued phenolic compounds of pistachio green hull extract. Food Chemistry, 220, 115-122. https://doi.org/10.1016/j.foodchem.2016.09.207
Rodriguez, I. F., Pérez, M. J., Cattaneo, F., Zampini, I. C., Cuello, A. S., Mercado, M. I., Ponessa, G., & Isla, M. I. (2019). Morphological, histological, chemical and functional characterization of Prosopis alba flours of different particle sizes. Food Chemistry, 274, 583-591. https://doi.org/10.1016/j.foodchem.2018.09.024
Rodsamran, P., & Sothornvit, R. (2018). Microencapsulation of Thai rice grass (O. Sativa cv. Khao Dawk Mali 105) extract incorporated to form bioactive carboxymethyl cellulose edible film. Food Chemistry, 242, 239-246. https://doi.org/10.1016/j.foodchem.2017.09.064
Tomé, A. C., & da Silva, F. A. (2022). Alginate based encapsulation as a tool for the protection of bioactive compounds from aromatic herbs. Food Hydrocolloids for Health, 2. https://doi.org/10.1016/j.fhfh.2021.100051
Tranquilino, E., Martínez-Flores, H. E., Rodiles-López, J. O., & Martínez-Avila, G. C. G. (2021). Nanoencapsulation and identification of phenolic compounds by UPLC-Q/TOF-MS2of an antioxidant extract from Opuntia atropes. Functional Foods in Health and Disease, 10(12), 505-519. https://doi.org/10.31989/FFHD.V10I12.763
Veggi, P. C., Cavalcanti, R. N., & Meireles, M. A. A. (2023). Production of phenolic-rich extracts from Brazilian plants using supercritical and subcritical fluid extraction: Experimental data and economic evaluation. Journal of Food Engineering, 131, 96-109. https://doi.org/10.1016/j.jfoodeng.2014.01.027
Villanueva Haro, S. R. (2025). Microencapsulación del extracto acuoso de Verbena officinalis L. (Verbena) mediante secado por aspersión y la eficiencia bioactiva en la digestión gastrointestinal in vitro. Tesis de grado. Universidad Nacional Agraria de la Selva.
Zorzenon, M. R. T., Formigoni, M., da Silva, S. B., Hodas, F., Piovan, S., Ciotta, S. R., Jansen, C. A., Dacome, A. S., Pilau, E. J., Mareze-Costa, C. E., Milani, P. G., & Costa, S. C. (2020). Spray drying encapsulation of stevia extract with maltodextrin and evaluation of the physicochemical and functional properties of produced powders. Journal of Food Science, 85(10), 3590-3600. https://doi.org/10.1111/1750-3841.15437